二类医疗器械注册代办流程
依据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规要求,医疗器械产品上市销售前需取得《医疗器械注册证》,生产企业在申请医疗器械注册证时需满足两个要求:
- 确定该产品在中华人民共和国的医疗器械管理类别。
- 需要有工商实体作为申请人,个体户不得作为申报主体。
医疗器械注册基本要求
具体如下:
产品分析
企业在选择注册产品时,需要对产品进行分析,核对《医疗器械分类目录》和《免于临床评价的医疗器械目录》,如果产品在这两个目录中,则注册相对比较容易。
如果《医疗器械分类目录》无相应产品,则需要分类界定。
核对的内容如下:
| 产品名称 | 产品名称是否和《医疗器械分类目录》一致 |
| 产品组成 | 结构组成是否少于或等于《医疗器械分类目录》的描述 |
| 预期用途 | 预期用途是否少于或等于《医疗器械分类目录》的描述 |
| 产品分类 | Ⅱ类或Ⅲ类 |
| 临床试验 | 产品是否和《免于临床评价的医疗器械目录》描述的一致 |
同类产品信息
确定是否有同类医疗器械产品已经注册上市,能否获得同类产品的技术指标。
生产场地要求
- 生产场地:需建设与生产规模相适应的生产场地、检验区域、仓库,如选择委托生产,则需要有研发场地。
- 生产管理:产品生产方需依据医疗器械GMP进行质量管理控制;
- 生产车间:无菌产品、体外诊断试剂产品需要有洁净车间,普通产品只需要有干净整洁的车间即可。
产品技术要求
产品技术要求是医疗器械注册阶段最重要的工作,产品注册检验、产品注册过程均以技术要求为核心。当产品技术要求和分类目录、临床试验豁免目录以及同类产品有实质性区别时,则需要进行分类界定和临床试验。
产品技术要求编制的工作为:
- 相关法规信息收集;
- 相关产品标准收集;
- 同类产品信息收集;
- 技术分析;
- 产品技术要求编制。
质量管理体系(GMP)
医疗器械质量管理体系是贯穿于整个产品生命周期的质量控制手段,生产企业需要建立包含对研发、生产、检验、采购、销售、人员的系统性管理要求。
质量管理体系在注册评审阶段以及生产许可证考核阶段将由所在地省级食品药品监督管理局实施检查,目前不接受第三方的审核报告。
质量管理体系建立依据:GB/T42061-2022《医疗器械 质量管理体系 用于法规的要求》、《医疗器械生产质量管理规范》,体系建立实施流程见下表:
医疗器械质量管理体系流程表
| 项目阶段 | 项目主题 | 项目内容 |
| 第一阶段 | 质量管理体系导入 | 组织机构确定 |
| 人员配备 | ||
| 体系导入培训 | ||
| 第二阶段 | 文件编制、审核 | 质量手册编制 |
| 程序文件编制 | ||
| 质量手册、程序文件审核 | ||
| 第三阶段 | 质量制度、质量记录编制 | SOP 编制 |
| 管理制度编制 | ||
| 操作规程、检验规程编制 | ||
| 第四阶段 | 样品生产 | 设计开发、工艺验证 |
| 样品生产 | ||
| 质量记录编制 | ||
| 第五阶段 | 内部考核 | 内部审核 |
| 管理评审 | ||
| 第六阶段 | 外部考核 | 药监局现场考核 |
注:整个体系培训运行时间约为3-5个月左右。
产品注册检验
医疗器械产品在开展临床试验前以及在注册申报时需要提交由医疗器械检验部门提供的基于产品技术要求的全性能检测报告,目前全国范围内经CFDA批准的具有医疗器械检验资格的检验部门共有几十家,各省均有分布。
产品注册检测送检要求如下:
医疗器械注册检验要求
| 序号 | 要求 | 说明 |
| 1 | 检验产品样品 | 送检样品为同一批次,数量满足全项目检验要求 |
| 2 | 检验协议 | 和检验单位签署协议 |
| 3 | 检验相关资料 | 包括风险分析资料、产品信息等 |
| 4 | 产品说明书 | 提供最终版的使用说明书或技术说明书 |
| 5 | 产品技术要求 | 提供完整版的产品技术要求 |
| 6 | 产品标签 | 样品或最小包装上要贴标签或铭牌 |
| 7 | 产品包装 | 无菌产品要有无菌包装,非无菌产品要有包装袋或包装箱 |
产品临床评价
产品如果在《免于临床评价的医疗器械目录》中,则不需要做临床试验。
如果不在目录中,产品按同品种对比途径,可不做临床试验,但是需要找到已经拿到注册证的产品的技术指标进行对比。
同品种对比大致流程如下:
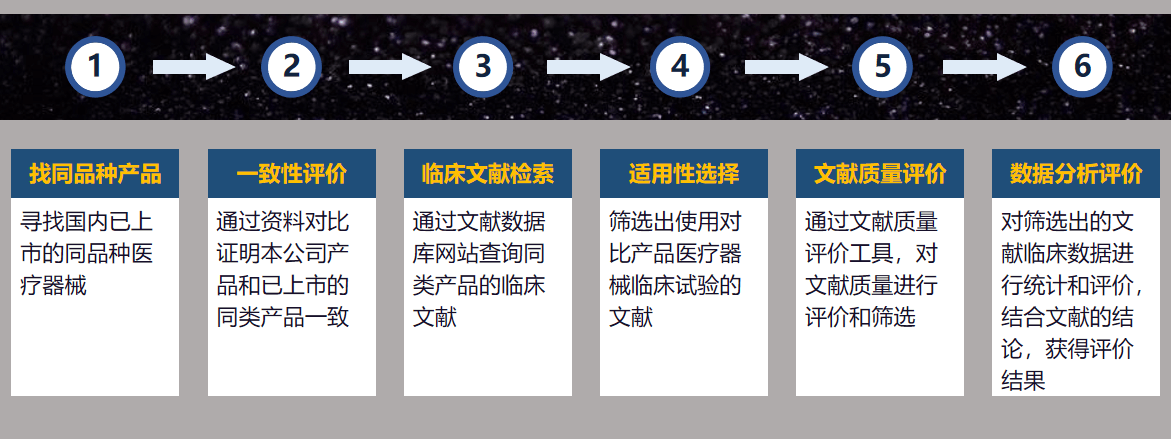
如果产品找不到同类产品资料,则可能需要临床试验。
产品注册申报
企业将符合医疗器械注册要求的资料编辑成册,并递交到相应医疗器械监管部门进行注册,资料经评审符合要求后,由监管部门予以核发“医疗器械注册证”。
注册受理部门:三类产品为国家药品监督管理局,二类产品为省级药品监督管理局。
医疗器械注册申报材料
申报资料一级标题 | 申报资料二级标题 |
1.监管信息 | 1.1章节目录 1.2申请表 1.3术语、缩写词列表 1.4产品列表 1.5关联文件 1.6申报前与监管机构的联系情况和沟通记录 1.7符合性声明 |
2.综述资料 | 2.1章节目录 2.2概述 2.3产品描述 2.4适用范围和禁忌证 2.5申报产品上市历史 2.6其他需说明的内容 |
3.非临床资料 | 3.1章节目录 3.2产品风险管理资料 3.3医疗器械安全和性能基本原则清单 3.4产品技术要求及检验报告 3.5研究资料 3.6非临床文献 3.7稳定性研究 3.8其他资料 |
4.临床评价资料 | 4.1章节目录 4.2临床评价资料 4.3其他资料 |
5.产品说明书和标签样稿 | 5.1章节目录 5.2产品说明书 5.3标签样稿 5.4其他资料 |
6.质量管理体系文件 |
我们的服务
医疗器械注册是一个涉及法律、法规和技术标准的时间和专业知识过程。
注册流程复杂,涉及到的相关方较多,容易出现各种疏漏,项目不确定性较大。
如果企业需要代办医疗器械注册证,我们可以提供全套注册申报流程服务,包括以下服务内容:
- 产品分析:协助企业收集研究适用的法规和标准,明确产品的类型以及注册过程的注意事项。必要时可协助企业进行分类界定申报。
- 技术资料编写:编写产品技术要求、说明书、标签。
- 产品检测:联系检验机构,协助企业完成送检、检测工作。
- 质量管理体系:质量管理体系(GMP)培训。
- 临床评价:编写同品种临床评价资料或开展临床试验。
- 注册资料编写和申报:编制注册申报资料、资料申报、补正整改等。
