依据《医疗器械监督管理条例》的规定,国家对医疗器械按照风险程度实行分类管理,其中第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
医疗器械注册
医疗器械在上市销售前,需要通过药监部门的审批,确保医疗器械注册人在医疗器械研制、生产、经营、使用全过程中的安全性、有效性风险得到有效控制。
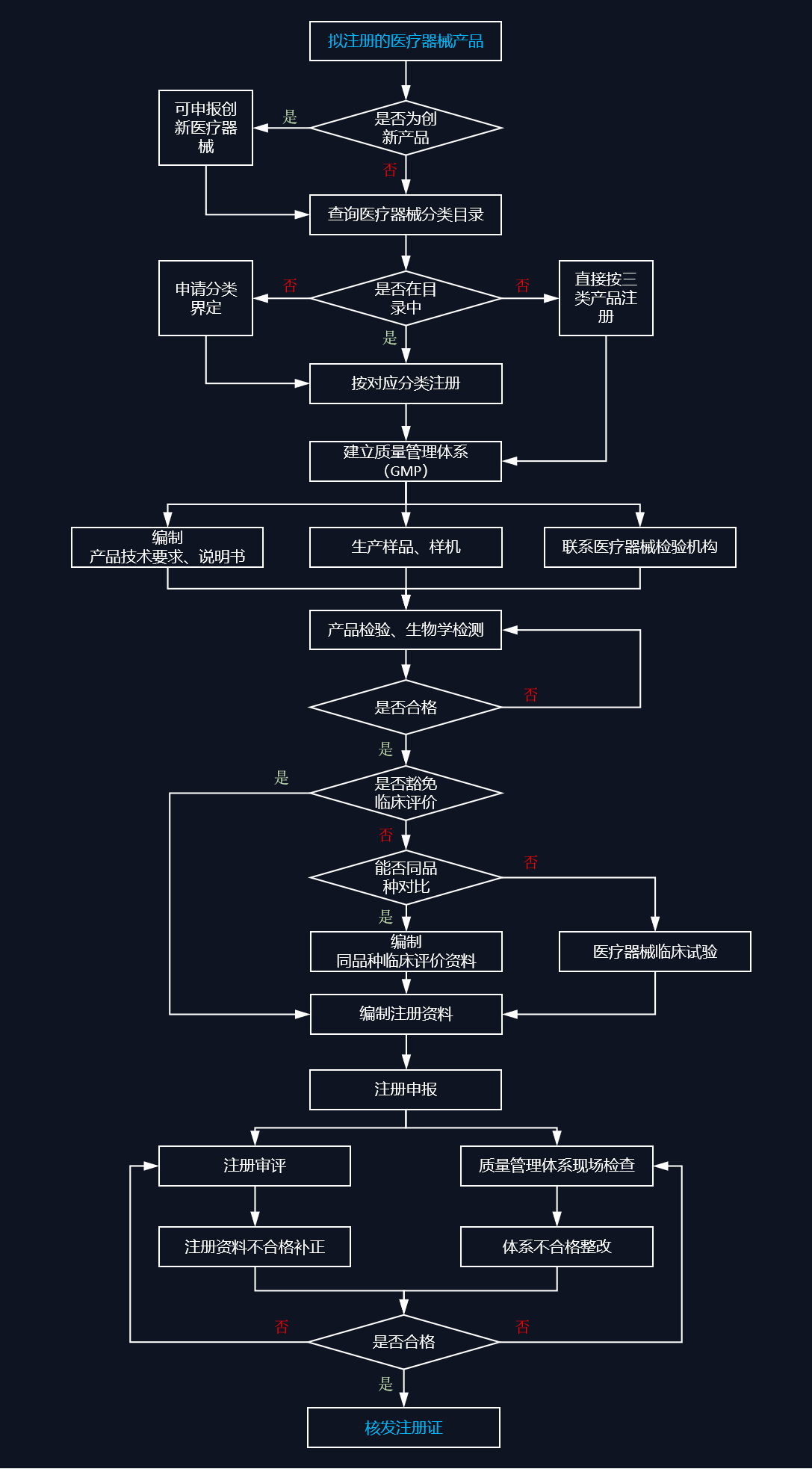
医疗器械的安全有效性风险包括设计风险、过程风险,控制方式为产品注册和质量管理体系,见下图:

三类医疗器械注册申报机构
第三类医疗器械注册受理机构为国家药监局医疗器械技术审评中心,地址为北京市。同时为兼顾各省份申报的便捷性,在全国其他地区又设立多家分中心,见下表:
标1 医疗器械技术审评中心列表
| 序号 | 机构名称 | 地址 | 联系电话 |
| 1 | 国家药品监督管理局医疗器械技术审评中心 | 北京市海淀区气象路50号院1号楼 | 010-86452722 |
| 2 | 国家药品监督管理局医疗器械技术审评检查长三角分中心 | 上海市浦东新区学林路36弄5号楼、6号楼 | 021-68662180 |
| 3 | 国家药品监督管理局医疗器械技术审评检查大湾区分中心 | 深圳市福田区槟榔道3号深港国际科技园G栋12-13层及第9层半层 | 0755-83087019 |
提示:第二类医疗器械产品注册由各省级药监局受理并审批。医疗器械注册过程漫长、不确定性多,企业可以寻找第三方代理援助服务。
三类医疗器械注册的标准流程
具体如下:
医疗器械类别的判定
医疗器械注册前需要明确产品的类别;
医疗器械类别可通过查询《医疗器械分类目录》,或查询2019年以来发布的医疗器械分类界定结果;
如无法查询到产品的分类信息,可通过申请分类界定或属性界定明确医疗器械的类别,或直接按第三类医疗器械申报。
质量管理体系
医疗器械质量管理体系是贯穿于整个产品生命周期的质量控制手段,生产企业需要建立包含对研发、生产、检验、采购、销售、人员的系统性管理要求。质量管理体系在注册评审阶段以及生产许可证考核阶段将由所在地省级食品药品监督管理局实施检查,目前不接受第三方的审核报告。
质量管理体系建立依据:GB/T42061-2022《医疗器械 质量管理体系 用于法规的要求》、《医疗器械生产质量管理规范》。
产品检验
申请注册的产品应当按照《产品技术要求》进行检验,并提交检验报告。
医疗器械产品检验报告可以是企业的自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告。
如产品预期直接或间接接触人体,检测还包括生物学评价检测。
临床评价
产品如果在《免于临床评价的医疗器械目录》中,则不需要做临床试验。
如果不在目录中,产品按同品种对比途径,可不做临床试验,但是需要找到已经拿到注册证的产品的技术指标进行对比。
如果产品找不到同类产品资料,则需要临床试验。临床试验需要找有临床资质的医疗机构开展试验。
注册申报
企业将符合医疗器械注册要求的资料编辑成册,并递交到相应医疗器械监管部门进行注册,资料经评审符合要求后,由监管部门予以核发“医疗器械注册证”。
医疗器械注册申报材料
| 申报资料一级标题 | 申报资料二级标题 |
| 1.监管信息 | 1.1章节目录
1.2申请表 1.3术语、缩写词列表 1.4产品列表 1.5关联文件 1.6申报前与监管机构的联系情况和沟通记录 1.7符合性声明 |
| 2.综述资料 | 2.1章节目录
2.2概述 2.3产品描述 2.4适用范围和禁忌证 2.5申报产品上市历史 2.6其他需说明的内容 |
| 3.非临床资料 | 3.1章节目录
3.2产品风险管理资料 3.3医疗器械安全和性能基本原则清单 3.4产品技术要求及检验报告 3.5研究资料 3.6非临床文献 3.7稳定性研究 3.8其他资料 |
| 4.临床评价资料 | 4.1章节目录
4.2临床评价资料 4.3其他资料 |
| 5.产品说明书和标签样稿 | 5.1章节目录
5.2产品说明书 5.3标签样稿 5.4其他资料 |
| 6.质量管理体系文件 |
第三类医疗器械通过国家局eRPS系统线上提交符合《医疗器械注册申请电子提交技术指南(试行)》要求的电子资料。
发补
审评中心在评审注册资料后,会向企业出具注册资料不合格一次性告知书,企业需要逐条进行改正并提供证明性材料。
审评中心对补正资料进行二次审评,合格之后予以核发注册证
第三类医疗器械注册流程
第三类医疗器械注册常规流程见下图:
三类医疗器械注册代办服务
三类医疗器械注册是一个涉及法律、法规和技术标准的时间和专业知识过程。注册流程复杂,涉及到的相关方较多,容易出现各种疏漏,项目不确定性较大。如果企业需要代办医疗器械注册证,我们可以提供全套注册申报流程服务,包括以下服务内容:
- 产品分析:协助企业收集研究适用的法规和标准,明确产品的类型以及注册过程的注意事项。必要时可协助企业进行分类界定申报。
- 技术资料编写:编写产品技术要求、说明书、标签。
- 产品检测:联系检验机构,协助企业完成送检、检测工作。
- 质量管理体系:质量管理体系(GMP)培训。
- 临床评价:编写同品种临床评价资料或开展临床试验。
- 注册资料编写和申报:编制注册申报资料、资料申报、补正整改等。
