《医疗器械生产监督管理办法》中第二十二条规定:从事第一类医疗器械生产的的企业,药品监督管理部门应当在生产备案之日起3个月内,对提交的资料以及执行医疗器械生产质量管理规范情况开展现场检查。本文对杭州市第一类医疗器械现场检查要点进行说明,供本地区生产企业参考。
第一类医疗器械现场检查
第一类医疗器械生产企业在取得“医疗器械生产备案凭证”后,当地药监部门将对生产企业进行现场检查。杭州市针对第一类医疗器械生产企业的现场主要包括以下几个方面:
表1 现场检查点
| 检查时机 | 取得“医疗器械生产备案凭证”后3个月内,一般一周内会通知 |
| 检查部门 | 所在地区县级市场监督管理局 |
| 关 注 点 | 人员、场地、设备、文件 |
| 检查依据 | 医疗器械生产质量管理规范 |
1)现场检查点1-人员
生产企业需要按照所提供的组织机构图,配备相应的人员,包括总经理、管理者代表、各部门负责人、检验员、操作工。组织机构图可参考下图:

图1 组织机构图
注意点:所有人员需要进行体检,体检结果需合格。
2)现场检查点2-场地
生产企业需要按照产品的工艺流程,配备相应的生产场地,包括生产车间、检验室、仓库。生产场地大小适宜,布局合理,可参考下图:
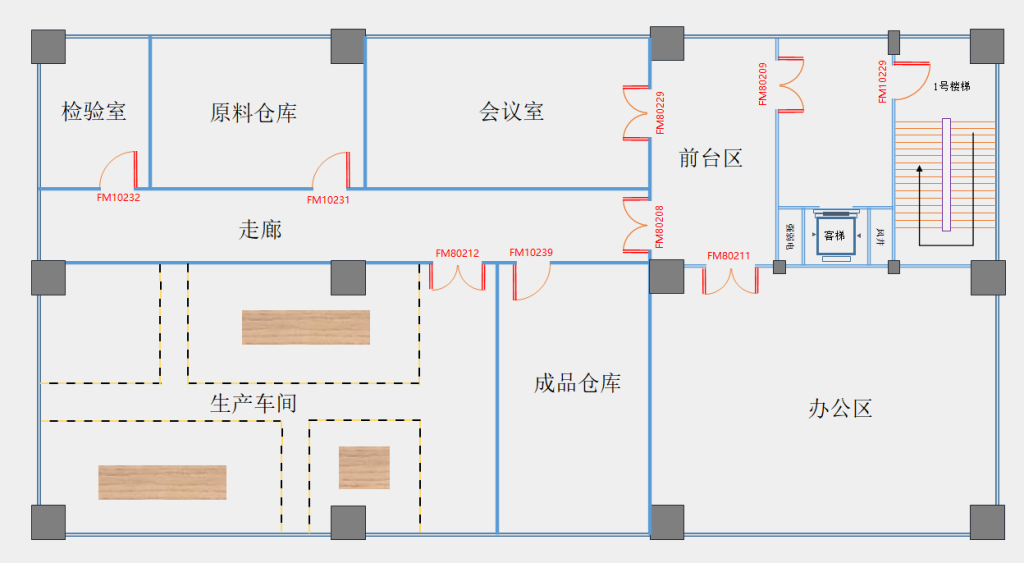
图2 第一类医疗器械生产企业布局示意图
注意点:生产场地应干净整洁,通风、照明良好。
3)现场检查点3-设备
生产企业需要按照所生产的产品工艺、技术要求,配备相应设备,包括生产设备、检验设备,常见的设备如下:
表2 常见的生产和检验设备
| 生产设备 | 生产线(桌子、椅子等)、生产设备(螺丝刀、注塑机、空压机、包装机等) |
| 检验设备 | 直尺、卷尺、游标卡尺、秒表、温湿度计等 |
注意点:检验设备需要每年校验,取得校验证书。
4)现场检查点4-文件
生产企业需要按照《医疗器械生产质量管理规范》建立质量管理体系,体系需要运行3个月以上。体系文件分为四层,见下图:
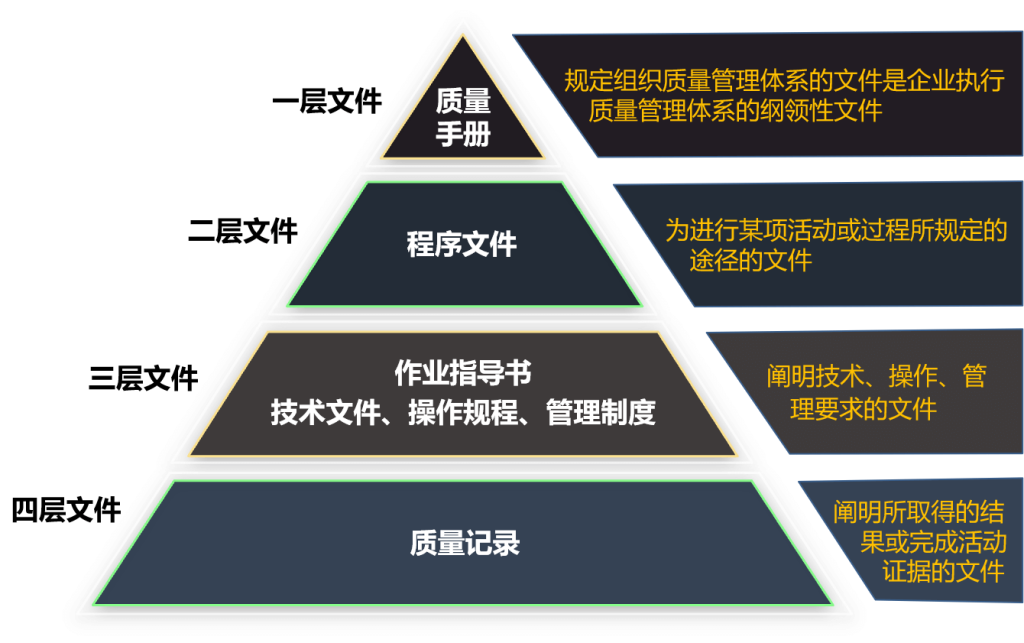
图3 质量管理体系文件层次
注意点:现场检查重点关注的文件包括《生产作业指导书(SOP)》、《原材料检验规程》、《过程检验规程》、《成品检验规程》,以及对应的记录表格。
