医疗器械临床试验是证明产品有效性的重要手段,医疗器械作为用于疾病治疗、检测、防护等功能的产品,其预期用途需要最终反映在使用者身上,因此直接在使用人群中实际使用该产品,能最直观评价产品是否能够实现预期的用途。受限于现实情况,临床试验不可能将全社会的所有适用人群全部纳入测试,只能选取有限的病例人群纳入试验。本质上,临床试验属于抽样检验,抽样检验过程中,抽样数量即临床试验病例数是其中最重要的参数。
1.抽样检验的两类错误
抽样检验指从一批样品中抽取少量样本进行试验,以抽样样本的合格率来反映整批样品的合格率。很多时候不合格样品在整批产品中并不是均匀分布(临床使用中个体差异),因此抽样的情况不一定能正确反映整体的实际情况,可能发生抽样检验的两类错误,即第一类错误(假阳性)和第二类错误(假阴性)。
1)假阳性错误
整批样品中绝大部分为合格产品,抽样的时候运气不好,刚好抽到几个不合格的,错误地判定整批不合格。临床试验中表现为整体有效,但纳入临床试验的几例病例恰好临床效果都不佳,误判为产品无明显临床效果。
2)假阴性错误
整批样品中不合格产品超过可接受比例,抽样的时候运气好,刚好抽到几个合格的,错误地判定整批可接受。临床试验中表现为整体无明显效果,但纳入临床试验的几例病例恰好临床效果都显著,误判为产品有明显临床效果。
3)错误发生的概率
实际上,抽样数量越多或临床试验病例数越多,试验结果越接近真实世界的临床应用结果,出于对临床试验成本的考虑,试验中无法大量纳入试验病例,因此计算病例数时,应尽量控制两类错误发生的概率,见下图:
2.临床试验的比较类型
临床试验的研究类型包括随机对照试验(RTC)、队列研究等,其中随机对照试验为主要的研究类型。对照试验需要将试验产品的临床效果和对照产品(或方法)进行比较,比较类型包括优效性试验、等效性试验、非劣效性试验,可依据临床方案的需求选择其中一种,区别见下表:
| 试验类型 | 选择说明 |
| 优效性试验 | 试验产品有效率优于对照品,统计学检验为单侧检验。 |
| 等效性试验 | 试验产品有效率等于对照品,统
计学检验为双侧检验。 |
| 非劣效性试验 | 试验产品有效率不低于对照品,统计学检验为单侧检验。 |
采用安慰对照的临床试验,需进行优效性检验。采用疗效/安全性公认的已上市器械或标准治疗方法进行对照的临床试验,可根据试验目的选择,如无特殊要求,一般选非劣效性试验,试验产品有效率要达到对照品90%以上。
3.临床试验病例数估算
医疗器械临床试验样本量需要符合统计要求,依据试验类型、适应症、主要指标的类型、临床意义的界值、检验的可信度和把握度、阳性率、脱落率及产品性质等确定。企业可自行设计样本量估算算法,或参考相应的法规和标准的推荐公式。以《医疗器械临床试验设计指导原则》中的平行对照、非劣效性试验公式为例: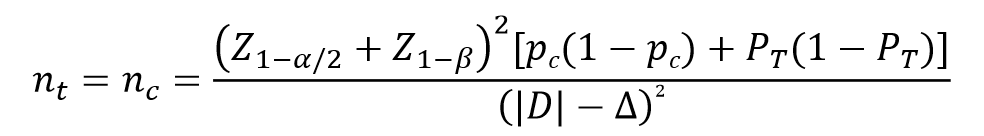
式中:nt——试验组样本量
nc——对照组样本量
∆——为非劣效界值(常取5%-10%)
Z1-α/2——为标准正态分布的分数位,当α=0.05时,Z1-α/2=1.96
Z1-β——为标准正态分布的分数位,当β=0.2时,Z1-β=0.842
PT——试验组预期事件发生率
PC——对照组预期事件发生率
|D|——|PT-PC|
由于该公式中非劣效界值、预期事件发生率等均为经验值或临床认可值,所以不同类型的产品临床样本量差异较大,根据临床试验经验,对于平行对照、非劣效试验的产品样本量估算参考给出以下参考,供企业在产品注册前进行成本和试验难度评估:
| 产品类型 | 样本量参考 |
| 普通Ⅱ类产品 | 120-160例 |
| 植入类产品 | 200-300例 |
| 高风险医疗器械 | 200-300例 |
| 体外诊断试剂(Ⅲ类) | 1000例 |
| 体外诊断试剂(Ⅱ类) | 200例 |
