企业在生产医疗器械时,需要有满足要求的医疗器械生产车间,同时《医疗器械生产质量管理规范》中2.1.1条款规定:厂房与设施应当符合生产要求。因此行业内经种说法,生产医疗器械时,需要具备GMP车间。
那么什么是医疗器械GMP车间?GMP车间有哪些要求?
什么是GMP车间?
首先医疗器械的法规中并没有关于GMP车间的表述。
GMP车间来源于药品生产,由于药品需要在洁净环境生产生产,因此药品生产企业需要建设药品洁净车间。在之前的监管条件下,药品生产企业需要取得GMP认证证书,故有“GMP车间”的表述。
医疗器械生产并无GMP认证,借用药品行业的表述,在医疗器械生产语境下,所谓“医疗器械GMP车间”即指符合《医疗器械生产质量管理规范》要求的生产车间。
同时,由于医疗器械对生产环境要求不同,可将医疗器械生产车间分为以下三类:
| 环境特性 | 车间环境要求 | 产品列举 |
| 非无菌医疗器械 | 非无菌生产车间 | 血压计、监护仪、CT机等 |
| 无菌医疗器械 | 洁净车间 | 注射器、血管支架、无菌棉签等 |
| 有微生物限度的医疗器械 | 洁净车间 | 体外诊断试剂、血液透析浓缩物、无菌包装等 |
非无菌车间
常规来说,第一类医疗器械、非无菌第二类医疗器械、非无菌第三类医疗器械均在非无菌车间环境下生产,当然也可选择在洁净车间环境下生产。
依据《医疗器械生产质量管理规范》的要求,非无菌车间需要符合以下要求:
| 序号 | 项目 | 要求 |
| 1 | 场地性质 | 有房产证明,以工业用地为佳,住宅、学校、军用性质区域均不得作为生产场地。 |
| 2 | 厂房面积 | 厂房面积满足所生产产品的特性、工艺流程、生产规模。一般需要200㎡以上。 |
| 3 | 外部环境要求 | 生产环境应当整洁、符合产品质量需要及相关技术标准的要求。厂房周围无明显的垃圾污染、无粉尘污染、无严重的噪音污染。有源产品还需要避开大型变电站等电磁干扰。 |
非无菌医疗器械厂房需要具备车间、原材料仓库、成品仓库、检验室(区)、留样室(视产品是否需要留样定)、办公区、会议室等区域,常规非无菌车间布局见下图:
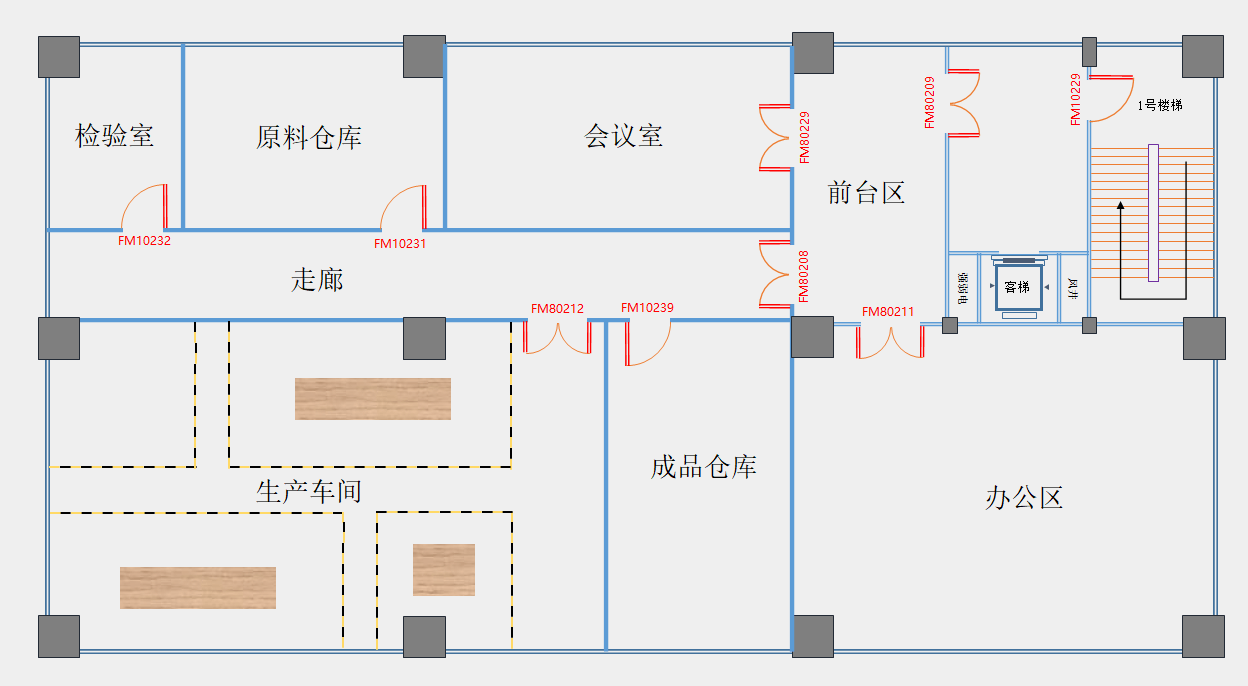
非无菌车间布置图
洁净车间
无菌医疗器械或有微生物限度要求的不灭菌医疗器械需要在洁净车间环境下生产,按洁净等级,洁净车间分为三十万级车间、十万级车间、万级车间、百级车间(区域)。其中百级要求最高,三十万级要求最低。
-1.png)
洁净车间 | 来源:医疗器械委托生产基地车间(青岛)
依据《医疗器械生产质量管理规范》的要求,洁净车间需要符合以下要求:
| 序号 | 项目 | 要求 |
| 1 | 场地性质 | 有房产证明,以工业用地为佳,住宅、学校、军用性质区域均不得作为生产场地。 |
| 2 | 厂房面积 | 厂房面积满足所生产产品的特性、工艺流程、生产规模。一般需要800㎡以上。 |
| 3 | 外部环境要求 | 生产环境应当整洁、符合产品质量需要及相关技术标准的要求。厂房周围无明显的垃圾污染、无粉尘污染、无严重的噪音污染。 |
| 4 | 洁净等级 | 需要依据产品和人体的接触性质选择适合产品的洁净等级,接触循环血液、中枢神经等的产品一般选择万级或百级洁净车间,其他医疗器械一般选择十万级车间,对微生物限度要求不高的产品可选择三十万级洁净车间。 |
我们的普通生活环境是一个充满微生物和颗粒物的环境,洁净车间目的在于保证环境中的微生物和粉尘不对最终医疗器械产品产生污染。洁净车间通过合理的布局设计、使用空气净化系统对空气进行净化、使用纯化水系统对用水进行净化,保证车间内部的污染物保持在一个可控的水平。
洁净车间需要定期对环境进行监视和检测,依据YY/T 0033-2000《无菌医疗器具生产管理规范》的要求,洁净车间的监测项目包括以下内容:
无菌医疗器具洁净室(区)环境要求
| 监测项目 | 技术指标 | ||||
| 100级 | 1 0000级 | 10 0000级 | 30 0000级 | ||
| 温度,℃ | (无特殊要求时)18~28 | ||||
| 相对湿度,% | 45~65 | ||||
| 风速,m/s | 水平层流≥0.4
垂直层流≥0.3 |
— | — | — | |
| 换气次数,次/h | — | ≥20 | ≥15 | ≥12 | |
| 静压差,Pa | 不同级别洁净室(区)及洁净室(区)
与非洁净室(区)之间≥5 |
||||
| 洁净室(区)与室外大气≥10 | |||||
| 尘埃数
个/m3 |
≥0.5 μm | ≤3500 | ≤35 0000 | ≤350 0000 | ≤1050 0000 |
| ≥5 μm | 0 | ≤2000 | ≤2 0000 | ≤6 0000 | |
| 浮游菌数,个/m3 | ≤5 | 100 | 500 | — | |
| 沉降菌数,个/皿 | ≤l | ≤3 | ≤10 | ≤l5 | |
可见不同洁净等级的洁净车间区别主要是尘埃粒子和微生物的区别,这两个指标又取决于洁净车间空气净化系统的换气次数。
无菌医疗器为何要在洁净车间里生产?
医疗器械生产企业经常会有一个疑问:无菌医疗器械最终需要灭菌处理,为什么还需要在洁净车间里生产?
主要基于以下几点原因:
- 产品灭菌无法消除颗粒物对产品的污染、有害物质对产品的污染;
- 医疗器械的灭菌无论是环氧乙烷灭菌或是辐照灭菌,都有灭菌参数的要求,例如环氧乙烷浓度、辐照剂量、灭菌时间等,灭菌参数基于产品的初始污染菌确定,洁净车间环境下能保证每批次产品的初始污染菌保持在可控范围内(如≤100CFU/件)。而非洁净车间无法保证,导致产品灭菌失效。