依据《医疗器械不良事件监测和再评价管理办法》的要求,医疗器械注册人和备案人需要履行不良事件监测主体责任。
企业在取得注册证或备案凭证后,需要申请不良事件监测账号,并上报上市产品信息、不良事件,以及获取相关方上报的本公司上市产品的不良事件信息,并予以处理。
医疗器械不良事件
1)医疗器械不良事件:是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。
2)可疑医疗器械不良事件:怀疑为不良事件,但没有最终确定的各种有害事件。
3)医疗器械不良事件监测:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。
4)死亡医疗器械不良事件报告:指患者最终结果为死亡的医疗器械不良事件报告。不表示患者的死亡与使用医疗器械有明确的关联性。
5)医疗器械不良事件报告原则:报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。报告内容应当真实、完整、准确。
6)导致或者可能导致严重伤害或者死亡的医疗器械不良事件应当报告;创新医疗器械在首个注册周期内,应当报告该产品的所有医疗器械不良事件。
不良事件监测和上报
国家医疗器械不良事件监测信息系统注册要求:注册人、经营企业和二级以上医疗机构应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件。
注册人应当持续跟踪和处理监测信息;产品注册信息发生变化的,应当在系统中立即更新。
医疗器械注册人在取得医疗器械注册证或备案凭证后,需要在“国家医疗器械不良事件监测信息系统”申请账号、设置密码。
网址为:https://maers.adrs.org.cn/console/login.ftl,登录界面如下:
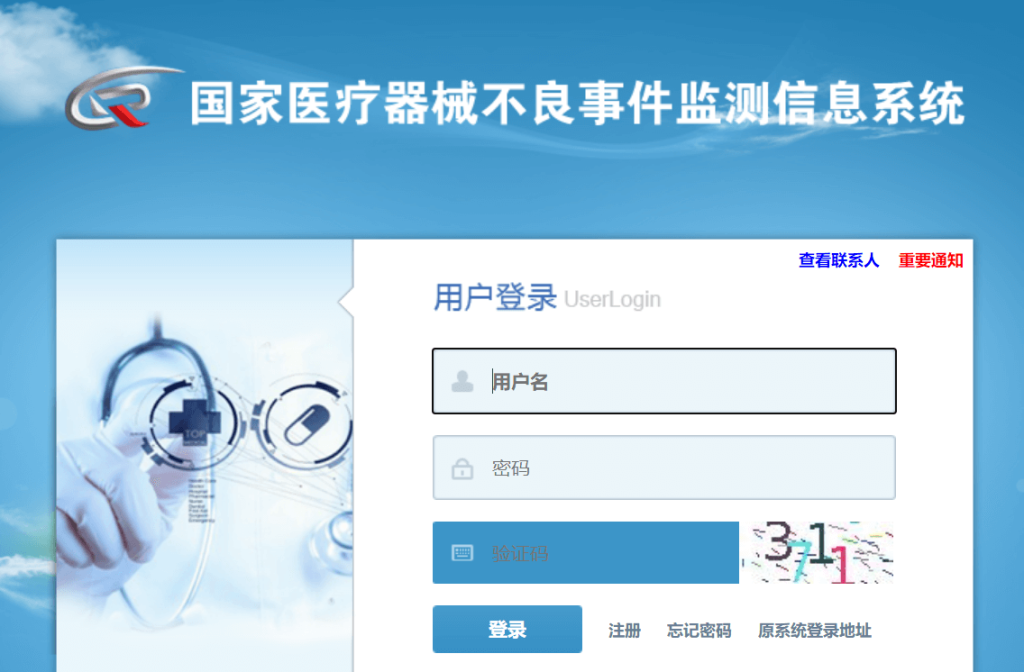
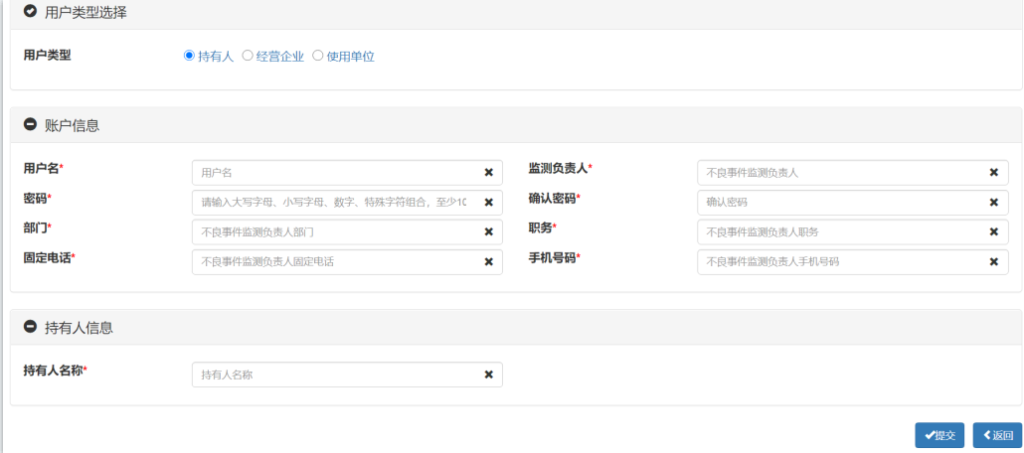
新开办的企业点击“注册”,跳转到注册界面,按实际情况填写并提交,生产企业用户类型为“持有人”,如下:
账号注册完成以后,即可登录网址,登录后需要完善已注册或备案的产品信息,界面如下:
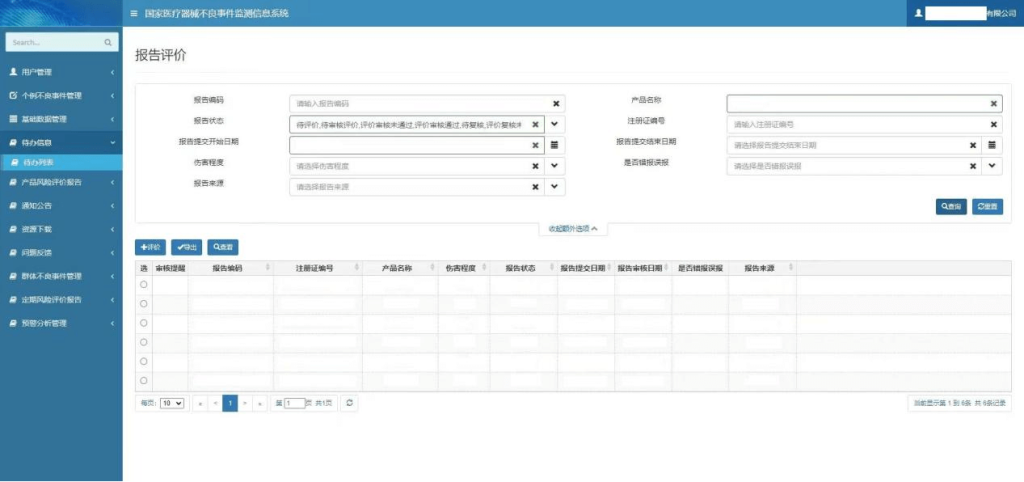
企业可通过对应的栏目,选择上报不良事件,或查询相关单位上报的不良事件信息。
不良事件的处理
目前医疗器械不良事件主要多见于使用单位、经营企业上报,注册人需要及时接收经销商和使用单位的反馈信息,以及定期在系统上查询各地上报的不良事件信息。
注册企业的不良事件处理第一责任人一般为总经理或管理者代表,责任人会同其他部门一起对不良事件进行上报和内部追溯处理。不良事件依据不同的原因,有不同的处理方式,大致处理流程如下:

