医疗器械工艺用气是医疗器械生产检验过程中使用的气体,其中无菌类产品由于在洁净环境下使用的工艺用气,需要与医疗器械产品直接或间接接触,其制备、使用等过程可能会对医疗器械产品质量造成影响。因此,洁净室(区)内使用的工艺用气需要加以控制,避免对医疗器械产品产生污染。
本指南由杭州亿维企业管理咨询有限公司根据多年的医疗器械GMP实践经验编制,可用于无菌医疗器械、IVD产品生产企业对工艺用气进行质量控制。
一、医疗器械工艺用气
如下:
(一)工艺用气
医疗器械工艺用气指生产医疗器械时,为满足产品生产工艺要求,通过工艺用气设备制备出供医疗器械生产检验使用的各种气体的总称。
常见的工艺用气包括压缩空气、氮气、氧气、氩气、二氧化碳等。医疗器械洁净室(区)内使用最多的工艺用气为压缩空气,压缩空气是经过空气压缩机压缩空气至一定压力后得到的气体,通过净化过滤处理后输入洁净室(区)环境使用。本指南以压缩空气为例,对工艺用气质量要求进行介绍。
(二)工艺用气使用方式
洁净区内使用的压缩空气主要用于产品的生产或清洁过程,按工艺用气对产品的影响,可分为3种方式,使用方式和质量风险见下表:
表1 工艺用气使用方式
| 使用方式 | 对产品影响 | 质量管理风险 |
| 1、用于生产 | 和产品直接接触
如喷涂、吹扫、除水、气密性检验等 |
1、产品污染
2、洁净区空气污染 |
| 2、用于清洁 | 和产品间接接触
如对模具吹扫、除水等。 |
1、可能对产品污染
2、洁净区空气污染 |
| 3、用于设备驱动 | 不和产品接触
仅对生产设备的气动元件提供驱动,如注塑机、包装机、气动螺丝刀等。 |
3、可能对洁净区空气污染 |
用于生产和清洁的工艺用气预期和产品直接和间接接触,需要对工艺用气进行质量检验。
用于设备驱动的工艺用气,经风险评估后的确没有污染风险的,可不对工艺用气进行检验(如集成在设备上的空气压缩机)。
(二)工艺用气制备
一般情况下,洁净区内使用的压缩空气工艺流程如下图:

图1 压缩空气制备流程
压缩空气使用的设备一般为:无油空气压缩机(压缩空气)、压缩空气储气罐(储存压缩空气备用)、压缩空气过滤器(除水、除油、除菌),设备连接图见下图:
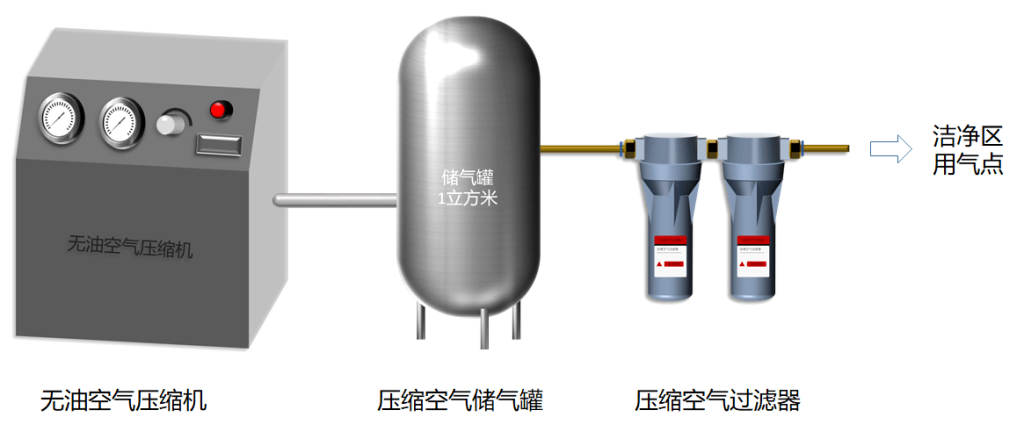
图2 压缩空气设备
二、工艺用气检验
如下:
(一)压缩空气污染源
压缩空气污染源主要有水分(包括水蒸气、凝结水)、油分(包括油雾、油蒸气)、尘埃粒子、微生物等污染物。
压缩空气设备本身有过滤设备,使用中会对空气进行过滤。随着设备的使用,过滤器会老化、管道阀门和设备会产生锈蚀、设备管道滋生细菌,进而污染产品,因此需要定期对压缩空气进行检验。
(二)压缩空气检验项目
1)水分
质量要求:压缩空气无水分
检验方法:
方法1:采用滤纸目测水分。滤纸目测操作方法:取一张干燥洁净的滤纸,放在压缩空气采样口处,打开开关,持续5分钟,目测观察或与另一张干燥洁净的滤纸进行空白对照,要求滤纸干燥,无可见水渍即为合格。
方法2:将气体样本通入变色硅胶,10分钟后观察硅胶是否变色,若不变色即为合格。
2)油分
质量要求:压缩空气无油分
检验方法:
方法1:采用滤纸目测油分。滤纸目测操作方法:取一张干燥洁净的滤纸,放在压缩空气采样口处,打开开关,持续几分钟时间,目测观察或与另一张干燥洁净的滤纸进行空白对照,要求滤纸干燥、没有明显的浸渍和变色即为合格。
方法2:将油水过滤器后的气体通入盛满干净的水的烧杯中,10分钟后观察水表面是否有油层。如无明显油层即为合格。
3)尘埃粒子
质量要求:按洁净区的洁净度要求,见下表:
表2 尘埃数与洁净度等级对比表
| 洁净度等级 | 尘埃最大允许数 个/m3 | |
| ≥0.5μm | ≥5μm | |
| 100级 | 3500 | 0 |
| 10 000级 | 350000 | 2000 |
| 100 000级 | 3500000 | 20000 |
| 300 000级 | 10500000 | 60000 |
检验方法:使用尘埃粒子计数器检测。先将压缩空气采样口与流量调节器的一端相连接;再将尘埃粒子计数器采样管与压缩空气采样装置另一端相连接;每次采样量必须满足最小采样量的要求;每点连续3次采样,记录3次的相近稳定数值,最后取3次平均值代表该采样点数值。
压缩空气采样装置可参考下图:
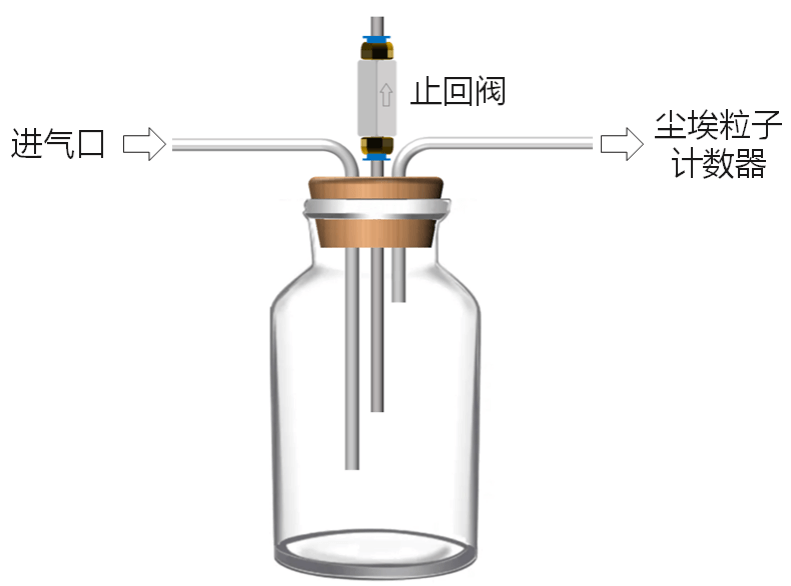
图3 压缩空气尘埃粒子检测简易采样装置
4)微生物
压缩空气的微生物限度指标目前无相应法规和标准规定,可参考以下两种方法进行微生物检测:
方法1:浮游菌检测法
质量要求:不同洁净度的洁净区域微生物要求见下表。
表3 微生物与洁净度等级对比表
| 洁净度等级 | 微生物最大允许数(个/m3) | 最小采样量 L/次 |
| 100级 | 5 | 1000 |
| 10 000级 | 100 | 500 |
| 100 000级 | 500 | 100 |
| 300 000级 | – | 100 |
检验方法:
先将压缩空气采样口与流量调节器的一端相连接;再将浮游菌采样器采样管与流量调节器另一端相连接;采样一次,应当满足最小采样量(见表4)的要求;每次采样时间不宜超过15min,不应当超过30min。最后按照《中华人民共和国药典》要求进行微生物检测,应当符合要求。
方法2:液体富集法
质量要求:菌落数≤100cfu。
检验方法:将300mL无菌生理盐水装入500mL广口瓶或锥形瓶,再将压缩空气通入该采样装置内,取样15min后,用夹子将进出气口加紧,使用微生物薄膜过滤器对生理盐水取样,后按照《中华人民共和国药典》要求进行微生物检验,应当符合要求。微生物采样装置在取样前应进行高压灭菌处理,装置可参考下图:
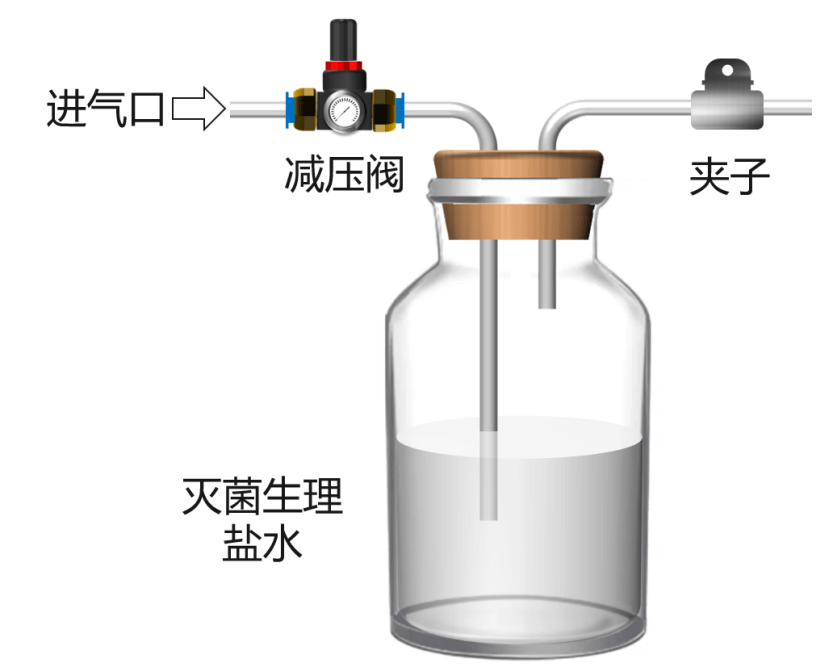
图4 压缩空气微生物简易采样装置
5)气体压力
质量要求:压缩空气的气压一般为0.7-0.8 MPa。
检验方法:读取空气压缩机上的压力数值。
(三)检验报告
1)检验周期
企业可依据洁净区的洁净等级以及生产产量安排检验周期,参考的检验周期见下表:
表4 检验周期与洁净度等级对比表
| 洁净度等级 | 检验周期 |
| 100级 | 每月/次 |
| 10 000级 | 每月/次 |
| 100 000级 | 每季度/次 |
| 300 000级 | 每季度/次 |
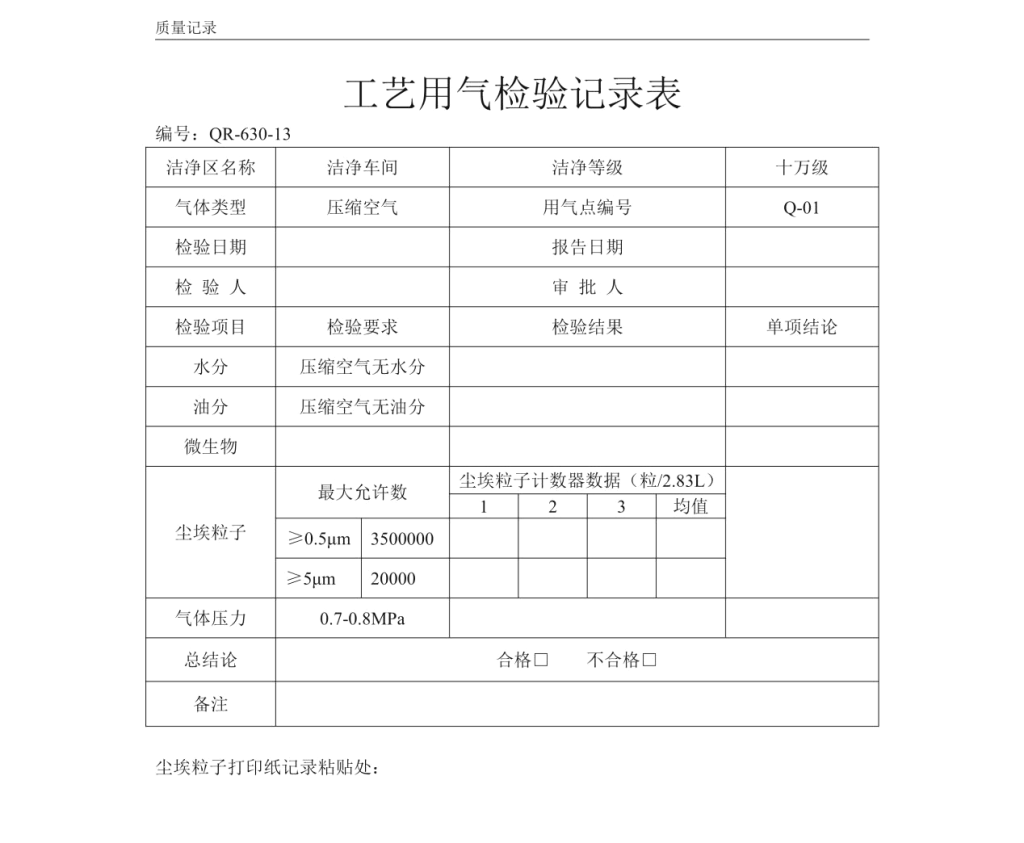
2)检验报告
参考的检验报告格式见下图:
 3)工艺用气设备确认和再确认
3)工艺用气设备确认和再确认
(1)工艺用气设备在首次使用前需要进行确认。
(2)工艺用气设备每年需进行再确认。
(3)日常检验的结果出现不合格时,应当对设备进行维修或更换,系统的维护、关键部件更换以及变更后,应当进行再确认。
(4)压缩空气系统进行搬迁后,应当进行再确认。
(5)停产一定周期后应当评估是否进行再确认。
